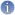Identification des Levures
Connaissances pré-requises concernant les levures
Les levures sont des champignons microscopiques unicellulaires de forme ovoïde à sphérique mesurant habituellement de (1 à 10 micron)
Sur un milieu riche, les levures se multiplient activement par bourgeonnement (reproduction asexuée) de sorte à former des colonies facilement visibles à l’œil nu en 24 ou 48H.
En condition de vie difficile certaines levures peuvent présenter une phase filamenteuse avec mycélium ou pseudomycélium.
Pour identifier les levures à partir d'un prélèvement médical, il est le plus souvent nécessaire de réaliser une mise en culture suivie d'un isolement, une infection multiple étant toujours possible. Les cultures obtenues sont analysées macroscopiquement et microscopiquement et des tests physiologiques ou biochimiques peuvent leur être appliqués en vue de l'identification.
L'on s'attache pour plus de certitude à rassembler un faisceau d'arguments convergents.
Lorsque l'infection est due à des organismes bien connus, il est désormais possible d'utiliser directement des méthodes moléculaires, notamment grâce à des techniques d'amplification du génome et de procéder à l'identification à l'aide de banques de données.
Caractères morphologiques
Lorsqu'on isole une levure il est important de tenir compte, outre ses paramètres de développement (type de milieu, température optimale, vitesse de développement), de son aspect macroscopique (texture et couleur) et des caractéristiques microscopiques suivantes :
Le type de bourgeonnement : unipolaire, bipolaire, unilatéral, multipolaire... et la section à la base, qui peut être plus ou moins large.
La taille et forme des cellules :
Recherche de spores particulières
arthrospores, chlamydospores...
On peut être amené à vérifier dans des conditions particulière la possibilité de
filamentation ou formation d'un tube germinatif (sérum enrichi en N-acétyl-glucosamine)
reproduction sexuée (périthèces, cléistothèces, asques et ascospores produits ou révélés sur des milieux ou par des colorations spécifiques)
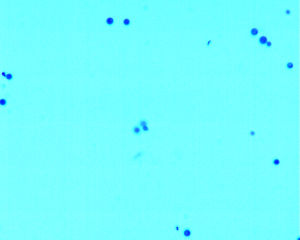
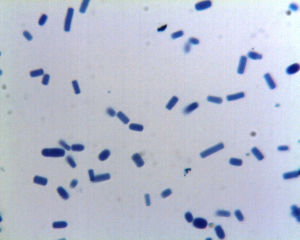
Bourgeonnements simple comme celui de Cryptococcus sur l'illustration ci-contre. La préparation photographiée est pauvre pour pouvoir observer très facilement la forme des levures (ronde dans le plan, sphériques dans l'espace) et les bourgeonnements (situés à un seul pôle sur la préparation et montrant une base large). |
Bourgeonnements multiples et pseudomycélium chez Saccharomyces. Noter la genèse du pseudomycélium : une levure bourgeonnant, tout en s'allongeant, de même que la blastospore-fille laquelle ne se sépare plus de la cellule mère et ainsi de suite car le champignon cherche à augmenter sa surface de contact avec le milieu dans lequel il puise ses nutriments. Cette situation se produit sur un milieu qui s'appauvrit par exemple en fin de culture ou sur un milieu pauvre sélectif tel que les milieux PCB ou RAT. Sur le pseudo filament ainsi formé on observe des étranglement entre les cellules fongiques voisines et non pas un septum, à la différence d'un véritable mycélium. |
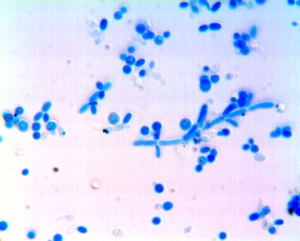
Recherche de chlamydospores et de pseudomycélium En situation critique, par exemple sur certains milieux de culture pauvres (tels les milieux PCB ou RAT) et en anaérobiose, les levures peuvent s'adapter et différentier des structures leur permettant de survivre comme par exemple le développement d'un pseudomycélium ou la formation de spores de résistance appelées chlamydospores Le pseudomycélium se développe pour permettre à la levure d'explorer plus largement son environnement en vue d'augmenter la surface d'absorption de nutriments. Lorsque les conditions de survie deviennent encore plus critiques, des spores de résistance à parois épaisses les chlamydospores se différentient. Le pseudomycélium perd alors de sa vitalité et n'est presque plus repérable sur la préparation. Par contre, les chlamydospores contenant en réserve le champignon potentiel sont bien visibles au le bleu lactique, le colorant vital habituellement utilisé en mycologie pour révéler les structures fongiques. Pseudomycelium et chlamydospores sont caractéristiques de Candida albicans et de l'espèce proche Candida dubliniensis |
Certains champignons sont capables de produire des éléments de dissémination (spores) directement à partir du filament mycélien qui se fragmente alors par un processus thallique : ce sont des arthrospores. Le genre Geotrichum est illustré ici sous une forme unicellulaire, aucun filament résiduel n'est visible sur la préparation qui a été réalisé à partir d'une subculture mature dans laquelle l'ensemble des filaments s'est résorbé par voie de fragmentation thallique. |
Caractères physiologiques
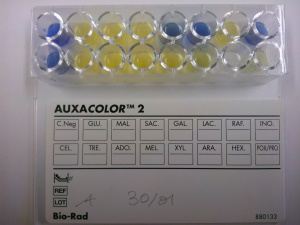
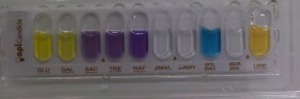
Auxanogrammes : assimilation et fermentation des sucres Les espèces fongiques étant dépendante de sources de carbone et d'azote, elles présentent des profils enzymatiques qui leur sont spécifiques permettant l'assimilation ou la fermentation plus ou moins large des différents sucres qu'elles peuvent rencontrer dans leur environnement. Toutes les espèces ne présentent donc pas les mêmes caractéristiques enzymatiques et ceci peut permettre de les distinguer. On recherchera notamment
Les profils ainsi obtenus (et traduits en chiffres) permettent de faire la discrimination (en consultant les tables de référence) entre des espèces de levures différentes, voire au sein d'une même espèce de distinguer des souches différentes. |
Des galeries spécifiques sont commercialisées pour des tests de routine comportant plusieurs sucres ou activités enzymatiques simultanément : API Candida® ou Auxacolor® Les modes opératoires reposent sur les mêmes principes : il s'agit de mettre le champignon en présence de différents substrats tapissant une série de puits ou cupules et d'observer le virage d'un indicateur coloré permettant d'apprécier si le caractère recherché est présent ou non. L'interprétation des résultats repose sur la transcription des observations par triplets qui seront codés pour donner un nombre référencé dans des tables assorties à chacune des techniques. |
Antifongigrammes La résistance spécifique éventuelle des champignons à certains antifongiques peut aussi constituer un élément de diagnostic et permet dans certain cas de distinguer différentes espèces de levures. Ainsi le fluconazole montre une bonne activité contre Candida albicans ou Cryptococcus neoformans alors que Candida krusei et Candida glabrata sont résistants. D'autres espèces de Candida (parapsilosis, tropicalis, kefir) montrent occasionnellement des résitances. De plus les résultats in vitro obtenus, peuvent se révéler particulièrement intéressants et utiles en cas d'échec d'un premier traitement. Différents kits commerciaux existent et permettent le plus souvent d'établir simultanément le degré de résistance à plusieurs antifongiques |
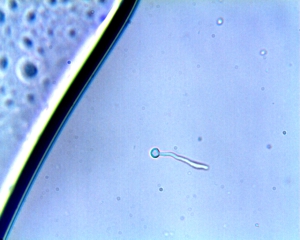
Test de blastèse ou test de Taschdjian ou test de filamentation Ce test permet de distinguer certaines espèces du genre Candida. Pour sa réalisation, il s'agit de mettre en évidence, lors de l'incubation en présence de sérum à 37°C et en moins de 3 heures, la formation d'un tube germinatif de longueur supérieure à 3 x le grand diamètre de la levure. Le filament ainsi formé ne présente pas de cloison. Ce test est positif pour l'espèce Candida albicans ainsi que pour sa proche voisine, Candida dubliniensis. Il est négatif pour Candida glabrata, tout comme pour Cryptococcus neoformans |
 | Les caractéristiques moléculaires sont de plus en plus souvent utilisées. En effet, grâce aux techniques d'amplification génomiques (PCR) et aux banques génomiques, il n'est plus forcément nécessaire de disposer d'un échantillon pur pour pouvoir caractériser un organisme. |